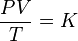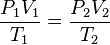En 1857, el físico alemán R. Clausius desarrolló un modelo que pretendía explicar la
naturaleza de la materia y reproducir su comportamiento. Se conoce como teoría cinético-molecular
o teoría cinética, y fue desarrollada inicialmente para los gases. Puede resumirse en las
siguientes premisas:
- Los gases están formados por partículas (átomos o moléculas) que se encuentran a grandes distancias en comparación con su tamaño, por lo que el volumen realmente ocupado por las moléculas es despreciable frente al volumen total, es decir, la mayor parte del volumen ocupado por un gas es espacio vacío.
- La moléculas están en un continuo movimiento aleatorio. Se desplazan en línea recta chocando entre sí y contra las paredes del recipiente. Estos choques son elásticos, es decir, en el choque una molécula puede ganar energía y la otra perderla, pero la energía total permanece constante.
- Las fuerzas atractivas de cohesión entre las moléculas, o fuerzas intermoleculares, son muy débiles o nulas.
- La temperatura es proporcional a la energía cinética media de las moléculas y, por tanto, a
la velocidad media de las mismas. Ec = ½ m V2
- La presión ejercida por un gas es proporcional al número de choques por unidad de superficie de las moléculas contra las paredes del recipiente que lo contiene.
LEYES DE LOS GASES IDEALES
Un gas queda definido por cuatro variables:
 Volumen
Volumen
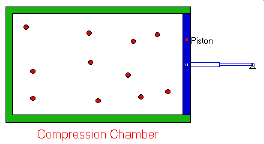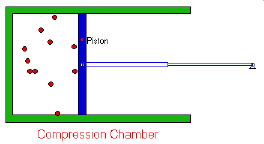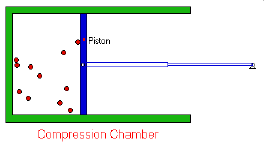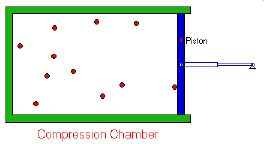
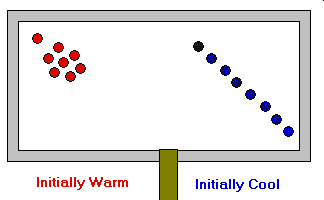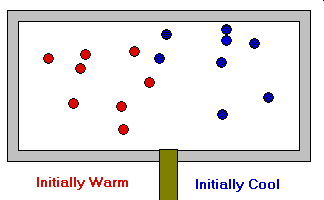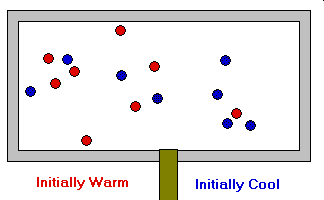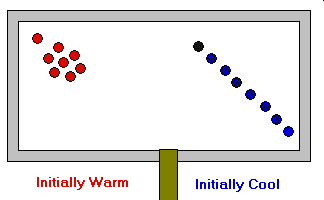
Presión Temperatura
Unidades:
Presión de los gases
http://www.educaplus.org/play-132-La-presi%C3%B3n-seg%C3%BAn-la-TCM.html?PHPSESSID=5f53e19d245eb250785d2cee421f9a52
http://portal.perueduca.edu.pe/modulos/m_termodinamica1.0/laboratorio/pressaogas.htm
DIRECCIÓN PARA TODAS LAS LEYES DE LOS GASES
http://www.educaplus.org/gases/tcm.html
(menú izquierdo leyes de gases)
Ley de Boyle y Mariotte
Experimento
Ley de Charles
El volumen de un gas es directamente proporcional a la temperatura absoluta (a presión y cantidad de materia constantes). V α T (a n y P ctes)
Experimento
Experimento
Un gas queda definido por cuatro variables:
- Cantidad de sustancia moles
- Volumen l, m3 , …
- Presión atm, mm Hg o torr, Pa, bar Pa = N/m2 (Unidad del SI)
- Temperatura ºC, K



Presión Temperatura
Unidades:
- 1 atm = 760 mm Hg = 760 torr = 1,01325 bar = 101.325 Pa
- K = ºC + 273
- 1l = 1dm3
Presión de los gases
http://www.educaplus.org/play-132-La-presi%C3%B3n-seg%C3%BAn-la-TCM.html?PHPSESSID=5f53e19d245eb250785d2cee421f9a52
http://portal.perueduca.edu.pe/modulos/m_termodinamica1.0/laboratorio/pressaogas.htm
DIRECCIÓN PARA TODAS LAS LEYES DE LOS GASES
http://www.educaplus.org/gases/tcm.html
(menú izquierdo leyes de gases)
Ley de Boyle y Mariotte
El volumen de un gas es inversamente
proporcional a la presión que soporta soporta (a
temperatura y cantidad de materia constantes).
V α 1/P (a n y T ctes)
Transformación isotérmica. PV = k
A temperatura constante, el producto de la presión por el volumen de una masa de gas permanece también constante.
P1.V1 = P2.V2
Por: Ruben Sebastian
Por: fq-experimentos
Ley de Charles
Transformación isobárica. V = k.T
A presión constante, el volumen de una masa de gas es directamente proporcional a su temperatura absoluta.
Por: Ruben Sebastian
Experimento
Por: luchin12tube
Ley de Gay-Lussac
La presión de un gas es directamente proporcional a la temperatura absoluta (a volumen y cantidad de materia constantes). P a T (a n y V ctes)
Transformación isocora. P = k.T
Por: Ruben Sebastian
Experimento
Por: Adrian León
LEY GENERAL DE LOS GASES
La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
ECUACIÓN DE ESTADO DEL GAS IDEAL
La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
Matemáticamente puede formularse como:
donde:
- P es la presión
- V es el volumen
- T es la temperatura absoluta (en kelvins)
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
Otra forma de expresarlo es la siguiente:
donde presión, volumen y temperatura se han medido en dos instantes distintos 1 y 2 para un mismo sistema.
Por: Ruben Sebastian
ECUACIÓN DE ESTADO DEL GAS IDEAL
Por: Ruben Sebastian
Experimento
Por: Juan Andres Padilla
SIMPLIFICACIÓN DE LAS LEYES DE LOS GASES IDEALES